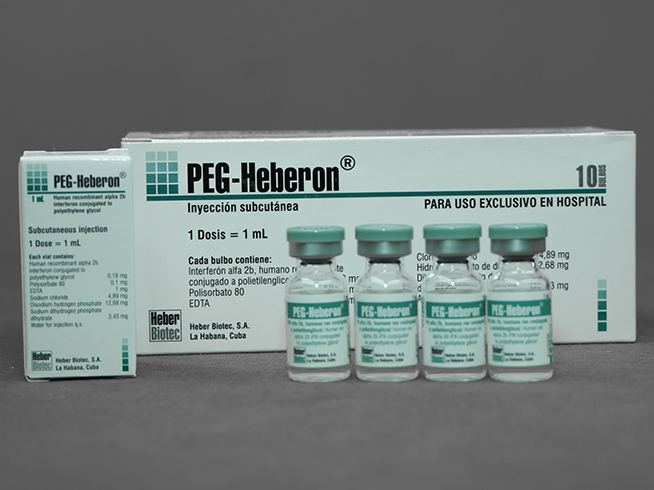
- Medicamento que contiene interferón alfa 2b humano recombinante conjugado a polietilenglicol para el tratamiento de las hepatitis B y C crónicas
- Con el empleo de PEG-Heberon® en combinación con ribavirina para el tratamiento de la hepatitis C crónica se alcanza hasta 40 % de respuesta virológica sostenida en pacientes con el genotipo 1 sin tratamiento previo.
- Luego de 6 meses de tratamiento con PEG-Heberon®, la replicación viral permanece no detectable.
- Con el empleo de PEG-Heberon®, el control de la enfermedad aumenta en 27 %, en comparación con la monoterapia convencional con interferón alfa.
Solución para inyección subcutánea
Interferón alfa 2b humano recombinante conjugado a polietilenglicol 0,18 mg/mL
- Estuche individual
- Estuche múltiple por 10 estuches con 10 bulbos
- Estuche por 10 bulbos
Cada 1 mL contiene interferón alfa 2b humano recombinante conjugado a polietilenglicol 0,18 mg; polisorbato 80; EDTA; cloruro de sodio; hidrogenofosfato de disodio (Na2HPO4); dihidrogenofosfato de sodio dihidratado (NaH2PO4 x 2H2O); agua para inyección.
Almacenar de 2 a 8 °C. No congelar.
El uso de PEG-Heberon® debe ser bajo prescripción facultativa, en pacientes que padecen:
- Hepatitis C crónica
Su empleo está dirigido a obtener respuesta virológica sostenida (RVS), definida como la no recurrencia de partículas virales detectables en suero o plasma a los 6 meses de finalizado el tratamiento. Este criterio puede interpretarse como la remisión o el control de la enfermedad viral hepática, y puede alcanzarse incluso en individuos con riesgo de complicaciones asociadas a cirrosis hepática o a carcinoma hepatocelular.
PEG-Heberon® está indicado en pacientes adultos con cirrosis hepática y sin cirrosis hepática, con enfermedad hepática compensada. Esta indicación incluye individuos previamente no tratados y sujetos sin respuesta o con recaída luego de la monoterapia con interferón alfa convencional o su combinación con ribavirina. También puede ser empleado en pacientes coinfectados con el virus de la inmunodeficiencia humana (VIH) o el virus de la hepatitis B (VHB), así como en pacientes que hayan recibido un trasplante hepático.
Los porcentajes más elevados de RVS se alcanzan al emplear PEG-Heberon® en combinación con ribavirina. Este tratamiento combinado se considera una de las opciones más ventajosas en la actualidad para cualquier paciente con diagnóstico de hepatitis C crónica. Aproximadamente entre el 70 y el 85 % de los pacientes infectados con los genotipos 2 o 3 del virus, que han reciben PEG-Heberon® tienen RVS tras 24 semanas de tratamiento. En cambio, solo se logra RVS en el 50 % de los infectados con los genotipos 1 o 4 tratados durante 48 semanas. Es posible la ocurrencia de porcentajes de RVS inferiores en subpoblaciones especiales de pacientes, como los coinfectados con hepatitis C crónica y VIH.
La duración y el esquema de dosificación de la combinación PEG-Heberon® y ribavirina pueden individualizarse por paciente, sobre la base del genotipo del virus, la carga viral basal y la respuesta virológica en la semana 12 de tratamiento.
La monoterapia con PEG-Heberon® está esencialmente indicada en los pacientes con intolerancia a la ribavirina o cuando la ribavirina esté contraindicada.
- Hepatitis B crónica
El empleo de PEG-Heberon® está dirigido a la seroconversión al antígeno e del virus de la hepatitis B (HBeAg) o a lograr respuesta virológica sostenida (RVS), definida como la no recurrencia de partículas virales detectables en el suero o el plasma a los 6 meses de finalizado el tratamiento. Estos criterios pueden interpretarse como la remisión o el control de la enfermedad viral hepática.
El PEG-Heberon® está indicado como monoterapia para la hepatitis B crónica con AgHBe positivo o AgHBe negativo en pacientes adultos con enfermedad hepática compensada, con evidencia de replicación viral, con cifras elevadas de alanina aminotransferasa y comprobada actividad necroinflamatoria con fibrosis o sin fibrosis.
En ambos casos, la duración del tratamiento recomendada es 48 semanas. Es posible obtener 32 % de RVS y seroconversión para AgHBe, mientras que en pacientes AgHBe negativos se obtiene 43 % de RVS.
La combinación de PEG-Heberon® con medicamentos antivirales no ha mostrado un incremento significativo de la respuesta terapéutica en los pacientes.
PEG-Heberon® está contraindicado en pacientes con hipersensibilidad a interferón alfa, a los productos derivados de Escherichia coli, al polietilenglicol (macrogol) o a cualquiera de las sales presentes en la preparación. Igualmente está contraindicado en hepatitis autoinmune; insuficiencia hepática severa o cirrosis descompensada; antecedentes de cardiopatía severa, incluyendo cardiopatía inestable o no controlada en el transcurso de los últimos 6 meses; lactancia y hemoglobinopatías.
No está demostrada su eficacia y toxicidad en los pacientes menores de 18 años.
En la administración asociada con la ribavirina, se debe consultar también la información profesional sobre la ribavirina.
- Sistema cardiovascular: aunque no se ha demostrado ningún efecto cardiotóxico directo, es posible que alguno de los efectos secundarios (por ejemplo, fiebre, escalofríos, malestar general) frecuentemente asociados con la administración de PEG-Heberon® exacerben una alteración cardiaca anterior.
- Sistema hematológico: el tratamiento con PEG-Heberon® se ha asociado con una disminución del recuento total de leucocitos, del recuento absoluto de neutrófilos y del recuento de plaquetas, que generalmente comienzan dentro de las 2 primeras semanas de tratamiento. Estas disminuciones son reversibles al reducir la dosis o al interrumpir la terapia.
Debido a que uno de los efectos tóxicos asociados con el uso de PEG-Heberon® puede ser leucopenia, se debe ser muy cuidadoso al administrarlo a pacientes con mielosupresión.
En el 15 % de los pacientes en tratamiento combinado con ribavirina, se ha observado la disminución de las cifras de hemoglobina hasta valores inferiores a 100 g/L.
- Sistema renal: como el riñón es el sitio donde se metaboliza el principio activo, se debe tener cuidado al usar PEG-Heberon® en pacientes con función renal comprometida, debiendo considerarse la reducción de la dosis si fuera necesario.
- Psiquiatría y sistema nervioso central (SNC): se han observado efectos graves en el SNC, concretamente depresión, ideación suicida e intento de suicidio en algunos pacientes durante el tratamiento con interferón alfa e incluso tras la interrupción del tratamiento, principalmente durante el período de seguimiento de 6 meses. Se han observado otros efectos sobre el SNC con los interferones alfa, incluyendo comportamiento agresivo (a veces dirigido hacia otras personas), confusión y alteraciones del estado mental. Se debe vigilar estrechamente a los pacientes con el fin de detectar cualquier signo o síntoma de trastornos psiquiátricos. Si estos síntomas aparecen, el médico debe tener en cuenta la gravedad potencial de estas reacciones adversas y debe considerar la necesidad de un tratamiento terapéutico adecuado. Si los síntomas psiquiátricos persisten o empeoran o se aprecia ideación suicida, se recomienda interrumpir el tratamiento con PEG-Heberon® y controlar al paciente, con el tratamiento psiquiátrico apropiado.
- Pacientes con existencia o antecedentes de acontecimientos psiquiátricos graves: si se considera necesario el tratamiento con PEG-Heberon® en pacientes con existencia o con antecedentes de acontecimientos psiquiátricos graves, este solamente se debe iniciar tras haber garantizado un diagnóstico individualizado apropiado y un tratamiento terapéutico psiquiátrico.
- Sistema endocrino: con el empleo de interferones alfa, se han observado anormalidades de la función tiroidea o empeoramiento de enfermedades tiroideas preexistentes. Los pacientes con estas alteraciones que no puedan ser controlados de manera efectiva con la medicación, no deben comenzar el tratamiento con PEG-Heberon® en monoterapia ni en combinación con ribavirina. Los pacientes que manifiesten estas alteraciones durante el tratamiento y que no puedan ser controlados con la medicación, deben interrumpir la terapia.
- Enfermedades autoinmunes: el uso de diferentes preparaciones de interferón alfa ha sido asociado a un incremento de manifestaciones alérgicas o autoinmunes como broncoconstricción, lupus eritematoso, psoriasis, dermatitis atópica o tiroiditis. Se debe mantener una vigilancia periódica en los pacientes con uso de PEG-Heberon® y antecedentes de cualquiera de estas manifestaciones. Los pacientes que desarrollen o exacerben estas alteraciones durante el tratamiento y que no puedan ser controlados la medicación, debe interrumpir la terapia.
- Cambios oculares: al igual que con otras formulaciones de interferones alfa, se han observado también con interferón pegilado en raras ocasiones, retinopatías, incluyendo hemorragias retinianas, manchas algodonosas, edema de papila, neuropatía óptica y obstrucción de las arterias o venas de la retina, que pueden ocasionar una pérdida de la capacidad visual. Los pacientes que desarrollen estas alteraciones durante el tratamiento y que no puedan ser controlados con la medicación, deben interrumpir la terapia con PEG-Heberon®.
- Trastornos pulmonares: como sucede con otras formulaciones de interferones alfa, se han descrito síntomas pulmonares, incluyendo disnea, infiltrados pulmonares, neumonía y neumonitis durante el tratamiento con PEG-Heberon®. En presencia de infiltrados pulmonares o de trastornos de la función pulmonar, persistentes o inexplicables, el tratamiento debe ser suspendido.
- Trastornos dentales y periodontales: se han comunicado trastornos dentales y periodontales que pueden conducir a la pérdida de dientes en pacientes que han recibido tratamiento con otras formulaciones de interferón alfa 2b pegilado en combinación con ribavirina. La sequedad bucal también podría tener un efecto perjudicial sobre los dientes y la mucosa bucal durante el tratamiento a largo plazo en combinación con ribavirina.
- Trasplante hepático: el PEG-Heberon® en combinación con la ribavirina puede emplearse para el tratamiento de la hepatitis C en pacientes receptores de trasplante hepático. El tratamiento se debe iniciar tras haber garantizado un diagnóstico individualizado apropiado y responder a un análisis riesgo-beneficio por el equipo médico responsable del paciente.
- Uso con ribavirina: se evidenciaron efectos teratogénicos y/o embriogénicos significativos en todas las especies animales expuestas a la ribavirina. Por lo tanto, el uso de PEG-Heberon® en combinación con ribavirina está contraindicado en la paciente embarazada. Se deberá tener una precaución extrema tanto en las pacientes femeninas como en las parejas femeninas de pacientes masculinos tratados con PEG-Heberon® en combinación con ribavirina, con el fin de evitar el embarazo. Tanto los pacientes como sus parejas sexuales deben emplear métodos anticonceptivos eficaces durante el tratamiento y los 6 meses posteriores al tratamiento. Se recomienda consultar la información profesional sobre la ribavirina.
PEG-Heberon® en monoterapia o en combinación con ribavirina debe administrarse bajo la supervisión de un médico especialista. El tratamiento puede provocar reacciones adversas de intensidad moderada o grave que obliguen a reducir la dosis, interrumpir de forma temporal el tratamiento o suspenderlo de forma definitiva.
Los efectos colaterales principales por el uso de PEG-Heberon® son similares a los reportados para otras preparaciones de IFN alfa. Estas reacciones adversas son dependientes de la dosis y reversibles. Su intensidad generalmente es grado I (no requiere tratamiento) o grado II (cede al tratamiento sintomático) de la Organización Mundial de la Salud. En caso de ocurrir, se deben tomar las medidas apropiadas de acuerdo con la situación del paciente. Aunque la experiencia general demuestra que los efectos colaterales disminuyen en la medida en que la terapia prosigue, su continuación o reinicio en estos casos debe ser monitoreada cuidadosamente.
En un ensayo clínico fase I aleatorizado, cruzado, a doble ciegas, que evaluó la seguridad biológica del PEG-Heberon® y el interferón alfa-2a humano recombinante (Pegasys) en 16 individuo, se obtuvo un perfil de eventos adversos similar para ambos productos. Con excepción del ardor en el sitio de administración, único con presencia en el 100 % para el interferón alfa-2b humano recombinante contra ningún para el interferón alfa-2a humano recombinante, los eventos adversos más frecuentes reportados por los sujetos para ambas formulaciones fueron leucopenia (87.5 %), fiebre (56.3 %), trombocitopenia (56.3 %), incremento de enzimas hepáticas (50 %) y astenia (25 %).
El uso de PEG-Heberon® en combinación con ribavirina en pacientes con hepatitis C crónica ha reportado la disminución de los niveles de leucocitos y hemoglobina como los eventos hematológicos más frecuentes (48 y 44 % respectivamente). Clínicamente, los eventos adversos más comunes fueron astenia (48 %, cefalea (26 %) y ardor en el sitio de la inyección (25 %) en el momento de la administración del PEG-Heberon® . La fiebre, artralgias y mialgias se reportaron en menos del 20 % de los pacientes tratados. La mayoría de estos eventos fueron reportados con intensidad leve, mientras que ninguno de los moderados ni severos fueron irreversibles o tuvieron consecuencias que afectaran o hicieran peligrar la integridad del paciente.
El esquema terapéutico con PEG-Heberon® debe ser establecido por un médico experimentado en el tratamiento a pacientes con hepatitis B o C. Cuando el PEG-Heberon® se utilice en combinación con ribavirina, deberá consultarse también la información profesional de la ribavirina.
- Hepatitis C crónica
Se recomiendan 180 μg de PEG-Heberon® una vez por semana, administrados por vía subcutánea en combinación con ribavirina por vía oral, o en monoterapia en los casos en que la ribavirina esté contraindicada. En pacientes con los genotipos 1 o 4, las dosis diarias estándares de ribavirina serán administradas en dependencia del peso corporal: 1200 mg para mayores de 75 kg y 1000 mg para menores de 75 kg. En pacientes con los genotipos 2 o 3 se administran 800 mg diariamente.
Los datos disponibles para pacientes infectados con los genotipos 5 o 6 son limitados; por consiguiente, se recomienda que sean tratados con un esquema similar al empleado para los genotipos 1 o 4.
La duración del tratamiento combinado con ribavirina en la hepatitis C crónica depende del genotipo viral y la reducción de la carga viral basal en las semanas 12 y 24 del tratamiento.
Los pacientes infectados con los genotipos 1, 4, 5 o 6, con partículas virales indetectables en la semana 12, deben ser tratados durante 48 semanas. En caso de que existan partículas virales detectables en la semana 12, pero reducción ≥ 2 log en la carga viral basal, se recomienda extender el tratamiento a 72 semanas. Cuando la reducción de la carga viral basal en la semana 12 sea inferior a ≥ 2 log, el paciente debe interrumpir definitivamente el tratamiento.
Los pacientes infectados por los genotipos 2 o 3, con partículas virales indetectables en la semana 12 deben ser tratados durante 24 semanas. En caso de que existan partículas virales detectables en la semana 12, pero reducción ≥ 2 log en la carga viral basal, se recomienda extender el tratamiento a 48 semanas. Cuando la reducción de la carga viral basal en la semana 12 sea inferior a 2 log, el paciente debe interrumpir definidamente el tratamiento.
Independientemente del genotipo viral y la carga viral existente en la semana 12 del tratamiento, todos los pacientes con partículas virales detectables en la semana 24 del tratamiento, deberán interrumpirlo definitivamente.
- Pacientes coinfectados con el virus de la hepatitis C y el virus de inmunodeficiencia humana (VIH)
La dosis recomendada de PEG-Heberon® en monoterapia o en combinación con 800 mg de ribavirina es de 180 μg en una inyección subcutánea semanal, independientemente del genotipo viral.
- Predicción de la respuesta virológica sostenida
La respuesta virológica temprana en la semana 12 del tratamiento, definida por una disminución de la carga viral ≥ 2 log o niveles indetectables de ARN del virus de la hepatitis C, es un importante valor predictivo de la respuesta virológica sostenida (RVS) a los seis meses de concluido el tratamiento. El consenso terapéutico de tratamiento de la hepatitis C crónica reconoce que existe un 98 % de valor predictivo negativo de RVS en los pacientes con menos de 2 log de reducción de la carga viral basal en la semana 12 de tratamiento.
- Hepatitis B crónica
La posología recomendada para los pacientes con hepatitis B crónica, tanto para los que tienen AgHBe positivo como para los que tienen AgHBe negativo, es de 180 μg de PEG-Heberon® una vez por semana durante 48 semanas, en administración subcutánea.
Como consecuencia de los efectos adversos de intensidad moderada o severa, principalmente sobre los parámetros hematológicos, se recomienda reducir la dosis de PEG-Heberon® hasta 135 μg. En ocasiones puede ser necesario reducir aún más hasta 90 μg o 45 μg o interrumpir temporalmente el tratamiento. Una vez que desaparezcan las reacciones adversas, se debe considerar la posibilidad de aumentar la dosis hasta recuperar los 180 μg iniciales.
Para el caso de pacientes coinfectados con VIH, se han notificado casos de exacerbación de la anemia debido a ribavirina cuando zidovudina forma parte del tratamiento del VIH, aunque aún no se ha determinado el mecanismo exacto. No se recomienda el uso concomitante de la ribavirina con la zidovudina debido al aumento del riesgo de anemia. Se debe considerar la sustitución de la zidovudina en el tratamiento antirretroviral combinado si éste ha sido previamente establecido. Esto es especialmente importante en pacientes con antecedentes de anemia inducida por la zidovudina.
No existen otras evidencias que indiquen que el tratamiento con PEG-Heberon® altere y/o modifique el metabolismo de otras drogas.
No existen estudios acerca del uso de PEG-Heberon® en mujeres embarazadas o lactantes. Por tanto, no existen elementos que impidan o establezcan su empleo seguro durante el embarazo. Su utilización debe ser únicamente bajo prescripción facultativa y responder a un análisis riesgo-beneficio del médico. Se debe interrumpir la lactancia antes de iniciar el tratamiento con PEG-Heberon®.
La influencia de PEG-Heberon® sobre la capacidad de conducir y utilizar máquinas es pequeña o moderada. Si el paciente presenta mareos, confusión, somnolencia o fatiga, debe advertírsele que debe evitar conducir vehículos o utilizar máquinas.
Se han descrito casos de sobredosis con productos similares, luego de la administración de 2 inyecciones en días consecutivos (en vez de dosis semanales) hasta inyecciones diarias durante una semana (es decir, 1.260 μg por semana). Ninguno de estos pacientes experimentó reacciones inusuales, graves o que limitaran el tratamiento. En estudios clínicos con productos similares, se administraron dosis semanales que alcanzaron 540 μg y 630 μg a pacientes afectados de carcinoma de células renales y leucemia mieloide crónica, respectivamente. Las reacciones tóxicas limitantes de las dosis, tales como fatiga, elevación de las enzimas hepáticas, neutropenia y trombocitopenia, son efectos característicos de la terapia con interferón.