Heberprot-P®
- Medicamento que contiene factor de crecimiento epidérmico humano recombinante para la cicatrización efectiva de las úlceras del pie diabético
- Única terapia en el mundo para la cicatrización efectiva de las úlceras del pie diabético neuropáticas e isquémicas, profundas y complejas.
- Heberprot-P® se infiltra en el interior de las úlceras del pie diabético para estimular y acelerar la cicatrización progresiva y sostenida, y reducir el riesgo de amputación en los miembros inferiores.
- Heberprot-P® es una formulación inyectable, diseñada para una necesidad médica no resuelta.
Resultados del tratamiento con Heberprot P®
83.9%
Lesión cubierta por tejido de granulación
46.2%
Con cierre completo de la lesión
71%
Pacientes no amputados
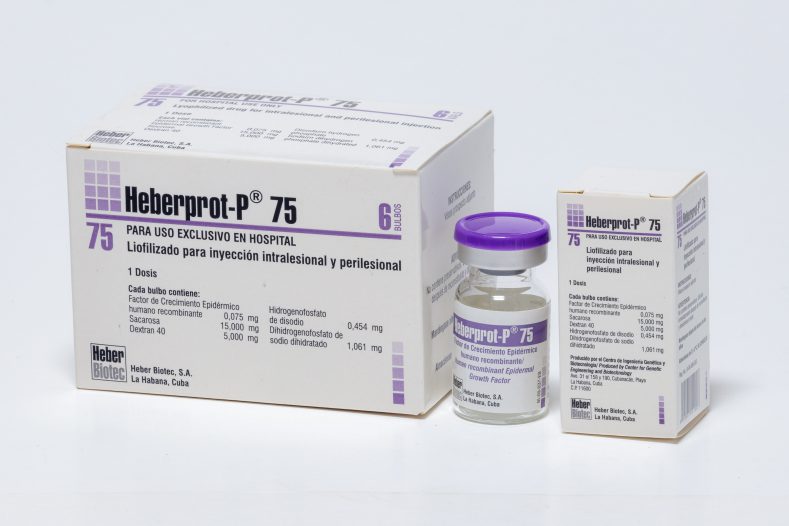
Liofilizado para inyección intralesional
75 µg/bulbo
- Estuche con bulbo de liofilizado + ampolleta de disolvente + 1 jeringuilla estéril de 5 mL con aguja 23G x 1½″ + 2 agujas estériles 24G x 1½″ o 24G x 3/4″ + 2 agujas estériles 26G x ½″
- Estuche por 1 bulbo con factor de crecimiento epidérmico humano recombinante (FCEhr) liofilizado de 75 μg
- Estuche por 6 bulbos con factor de crecimiento epidérmico humano recombinante (FCEhr) liofilizado de 75 μg
Cada bulbo de liofilizado contiene factor de crecimiento epidérmico humano recombinante (FCEhr) 75 μg; sacarosa 15 000 mg; 5000 mg de dextran 40; hidrogenofosfato de disodio 0,454 mg; dihidrogenofosfato de sodio dihidratado 1,061 mg. Cada ampolleta de disolvente contiene agua para inyección.
Temperaturas entre 2 y 8 °C. No congelar.
Heberprot-P® solo se debe usar bajo prescripción facultativa. Está indicado, junto a otras terapias convencionales, para la cicatrización de las úlceras del pie diabético neuropáticas e isquémicas, con un área superior a 1 cm2, para estimular la formación de tejido de granulación útil, que permita el cierre por segunda intención o mediante autoinjerto de piel, según ha sido demostrado en varios estudios clínicos.
El Heberprot-P® se encuentra contraindicado en:
- Pacientes con antecedentes de hipersensibilidad al producto o a cualquiera de sus componentes.
- Pacientes con eventos cardiovasculares agudos como: infarto agudo del miocardio, angina de pecho severa, accidente cerebrovascular agudo o isquemia transitoria o eventos tromboembólicos en los tres meses previos.
- Pacientes con insuficiencia cardíaca congestiva severa (clasificación NYHA III y IV), bloqueo aurículo-ventricular severo (grado III) y fibrilación auricular con ritmo descontrolado.
- Pacientes con historia personal o sospecha de enfermedades malignas.
- Pacientes con coma diabético o cetoacidosis diabética.
La administración de productos biológicos debe ser cuidadosa y tomando las medidas necesarias en caso de reacciones adversas inesperadas. Antes de usar Heberprot-P® se deben tratar posibles afecciones coexistentes, como infección y osteomielitis. Se debe realizar un tratamiento adecuado de la infección de la lesión, antes del uso de Heberprot-P®.
En los pacientes con isquemia severa por macroangiopatía periférica se recomienda realizar algún procedimiento de reperfusión del miembro afectado.
Se desconoce si Heberprot-P® pasa a la leche materna. No se recomienda su uso en las madres lactantes. Hasta el momento no se dispone de datos suficientes que avalen su uso en embarazadas y pacientes pediátricos, por lo que el médico debe hacer un balance riesgo-beneficio en cada caso.
Se debe administrar con precaución en pacientes con antecedentes personales de eventos cardiovasculares agudos tales como: infarto agudo del miocardio, accidente cerebrovascular o isquemia transitoria o tromboembolismo; así como en pacientes con enfermedad valvular clínicamente relevante (i.e. válvulas aórticas calcificadas), hipertensión arterial severa e historia de trombosis venosa
Se debe administrar con precaución en pacientes con insuficiencia renal con creatinina mayor de 200 μmol/L, por lo que el médico debe hacer un balance riesgo-beneficio en cada caso.
En las lesiones sospechosas de malignidad se debe realizar una biopsia para excluir la existencia de una neoplasia, previo al uso de Heberprot-P®.
El tratamiento debe ser realizado por un personal entrenado y con experiencia suficiente en el tratamiento de las úlceras del pie diabético, que disponga de instalaciones diagnósticas necesarias. Las soluciones diluidas de Heberprot-P® deben administrarse inmediatamente después de su preparación. Este medicamento solo podrá utilizarse hasta la fecha de caducidad indicada en el bulbo.
Los efectos adversos más frecuentes son leves y moderados: dolor y ardor en el sitio de la inyección, escalofríos, tremores de frío, infección local y fiebre.
Heberprot-P® debe utilizarse siempre junto con el cuidado adecuado de las úlceras del pie diabético, que consiste en el desbridamiento oportuno de las lesiones, el alivio de las zonas de presión y las curas sistemáticas. Se debe realizar el diagnóstico y tratamiento adecuado de la infección de la úlcera, previo al uso de Heberprot-P®.
Heberprot-P® se administrará a razón de 75 µg diluidos en 5 mL de agua para inyección, 3 veces por semana por vía intralesional. Las administraciones se mantendrán hasta que se logre la granulación completa de la lesión, el cierre de esta mediante injerto o se alcance un máximo de 8 semanas de tratamiento.
Se debe descontinuar el tratamiento en caso de que se alcance tejido de granulación útil que cubra toda la extensión de la lesión, o en caso de que se logre una reducción del área hasta menos de 1 cm2.
Las infiltraciones deben hacerse después de la cura de las lesiones. El producto se infiltra en los bordes de las úlceras con agujas de 26G x ½″; y en el fondo, en el caso de las lesiones profundas, se deben usar agujas de 24G x 1½″ o 24G x ¾″. Se deben infiltrar primero las zonas más limpias de la lesión, y cambiar de aguja en los diferentes sitios de punción, con el fin de evitar la transmisión de una posible infección de un sitio a otro. Posteriormente, la lesión debe cubrirse con un apósito de gasa humedecido con solución salina, que mantenga el ambiente húmedo y limpio.
Si después de 3 semanas de tratamiento continuado no se forma tejido de granulación útil en el lecho de la úlcera, se debe reevaluar el tratamiento, y valorar si están influyendo otros factores que puedan dificultar la cicatrización; entre ellos, osteomielitis, infección local o descontrol metabólico.
Interacciones con otros medicamentos y otras formas de interacción: No se conoce si Heberprot-P® interacciona con otros medicamentos de uso tópico, es por ello que se recomienda no aplicarlo con otros productos tópicos.
Embarazo: No se disponen de datos suficientes que avalen su uso en embarazadas.
Lactancia: Se desconoce si Heberprot-P® pasa a la leche materna. No se recomienda el uso en madres lactantes.
Los pacientes que están en tratamiento con Heberprot-P® no deben conducir vehículos ni maquinarias.
No se ha producido ningún caso de sobredosis ni se conocen antídotos para este producto. Por la aplicación local de Heberprot-P® y por el compromiso circulatorio de los pacientes diabéticos con lesiones avanzadas, es poco probable que puedan producirse efectos sistémicos.