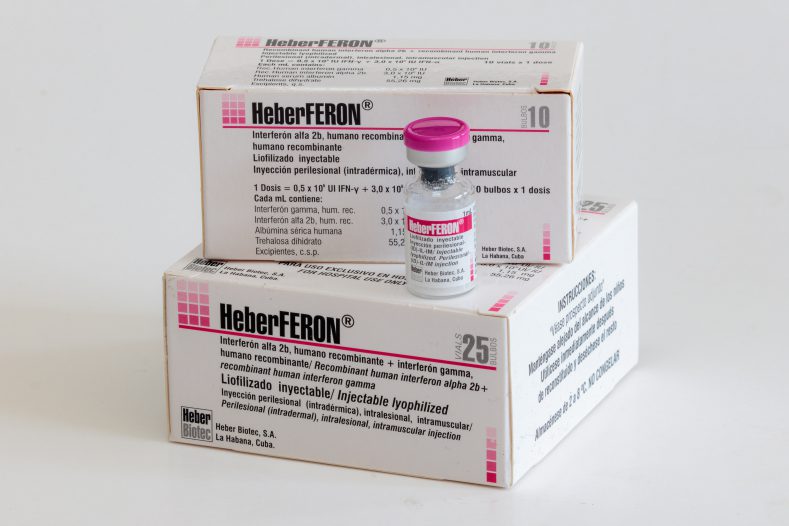
HeberFERON®
- Combinación farmacéutica en proporción sinérgica de interferón alfa 2b humano recombinante e interferón gamma humano recombinante para el tratamiento del carcinoma basocelular.
- Tratamiento de lesiones causadas por carcinoma basocelular.
- HeberFERON® reduce la masa tumoral.
- Induce una respuesta terapéutica rápida.
- Prolonga la respuesta al tratamiento al menos 5 años.
- Disminuye en 8 veces la frecuencia de aparición de nuevas lesiones.
- Evita complejas cirugías en las zonas de alto riesgo (periocular, orejas, nariz, cuero cabelludo) y sus secuelas. HeberFERON® mejora la calidad de vida de los pacientes.
- Deja una excelente estética en el sitio de la inyección.
Forma farmacéutica: Liofilizado para inyección intralesional, intradérmica e intramuscular.
5,0 x 105 UI IFN-γ + 3,0 x 106 UI IFN-α
- Estuche con 10 bulbos
- Estuche con 25 bulbos
Cada 1 mL contiene interferón alfa 2b humano recombinante 3,0 x 106 UI; interferón gamma humano recombinante 5,0 x 105 UI; albúmina sérica humana; trehalosa dihidrato; ácido succínico; agua para inyección.
Almacenar entre 2 y 8 °C.
HeberFERON® está indicado para el tratamiento perilesional (intradérmico) o intralesional del carcinoma basocelular confirmado por biopsia. Puede utilizarse como tratamiento alternativo o adyuvante de otros procedimientos (quirúrgicos o no), así como en lesiones de cualquier tamaño, subtipo clínico y localización, incluso de alto riesgo (como en la zona H de la cara) o localmente avanzadas (como las lesiones difíciles de tratar, por presentar invasión local y/o proximidad a estructuras importantes como los ojos y el cerebro).
HeberFERON® está contraindicado en pacientes con hipersensibilidad a cualquiera de los interferones (alfa o gamma) o a cualquiera de los ingredientes presentes en la preparación. También está contraindicado en pacientes con enfermedades autoinmunes, puesto que la administración de interferones puede exacerbarlas, y en pacientes con esclerosis múltiple, ya que se ha reportado que la administración de interferón gamma puede provocar su exacerbación.
HeberFERON® debe ser administrado con precaución a pacientes con antecedentes de enfermedad cardíaca severa, alteraciones renales o hepáticas severas, convulsiones u otra alteración funcional del sistema nervioso central y enfermedades autoinmunes o alérgicas. Como se ha reportado la ocurrencia de mielosupresión por el uso de interferones, se debe controlar el estado hematológico de los pacientes que reciben este medicamento.
Aunque no se ha demostrado ningún efecto cardiotóxico directo, en pacientes con enfermedad cardíaca o con historia de trastornos cardíacos, es posible que alguno de los efectos secundarios (por ejemplo, fiebre, escalofríos, cefalea) frecuentemente asociados con la administración de cualquiera de los interferones, exacerben una alteración cardíaca anterior.
Las reacciones adversas producidas por HeberFERON® son reversibles. Si ocurrieran, se debe reducir la dosis o interrumpir el tratamiento, según el caso, y tomar las medidas apropiadas de acuerdo con la situación del paciente. Aunque la experiencia general es que los efectos colaterales disminuyen en la medida en que la terapia con HeberFERON® prosigue, su continuación o reinicio en estos casos debe ser monitoreada cuidadosamente.
Este medicamento solo podrá utilizarse hasta la fecha de caducidad indicada en el envase. Debe usarse inmediatamente después de reconstituido. Al agregar el agua para disolverlo debe evitarse la formación de espuma, para lo cual se recomienda que el líquido caiga suavemente por las paredes del frasco. No debe usarse si, una vez reconstituido, presenta precipitado, turbidez o color. No reutilizar si quedara contenido (desechar).
Los efectos colaterales principales encontrados en el uso de HeberFERON® son similares a los presentados por sus componentes de forma individual (interferones alfa y gamma), pero de menor intensidad. Estas reacciones adversas son reversibles y dependientes de la dosis. Su intensidad es generalmente leve (no requiere tratamiento) o moderada (responde al tratamiento sintomático). Las principales reacciones de los casos estudiados han sido: fiebre (42,1 %), escalofríos (21,1 %), artralgias (5,3 %), mialgias (26,3 %), astenia (15,8 %), alergia (1,7 %), prurito (1,7 %), pérdida de peso (1,7 %), trombocitopenia (1,7 %) y leucopenia (1,7 %). No se ha reportado elevación de los niveles séricos de marcadores de daño hepático o renal en dosis inferiores a los 20 MUI. Por vía intracraneal se han observado reacciones adversas típicas a los interferones como fiebre, cefalea, vómitos, somnolencia y otros menos comunes como reacciones extrapiramidales, afasia y disfasia. Todas las reacciones son reversibles por reducción de la dosis y/o la frecuencia o descontinuación de la administración del producto. Se han producido episodios de isquemias cerebrales transitorias en algunos casos con antecedentes de esta situación clínica, solo en la zona del párpado inferior.
Calcule la cantidad de producto total a utilizar. Según el área de la lesión, distribuya 1 mL (cc) de la dosis total de HeberFERON® de 10,5 MUI por cada 1,5 cm2 de superficie de la lesión.
Reconstituya 3 bulbos de HeberFERON® con 1 mL (cc) de agua para inyección (USP). Adicione el diluente dejándolo caer suavemente por las paredes de los frascos, invirtiéndolos (sin agitar y sin formar espuma) hasta la total disolución de sus contenidos, para esto auxíliese de una jeringuilla con aguja 24G x 1½″.
Adicione el contenido del primer bulbo de HeberFERON® (extraído con la aguja 24G x 1½″) al contenido del segundo bulbo de HeberFERON® y de la misma forma al tercer bulbo de HeberFERON®. Si el volumen total a inyectar calculado fue superior a 1 mL, pase este volumen de la mezcla de los 3 bulbos de HeberFERON® a un frasco estéril con un volumen de 10 mL y llévelo al volumen total calculado (necesario) con agua para inyección.
Aplicar el medicamento de forma equidistante bordeando la lesión, a una distancia de 3 a 5 mm del borde tumoral (perilesional / intradérmica). Introducir la aguja 26 corta o larga con el bisel hacia arriba y con un ángulo de 15° (intradérmico). Infiltrar el medicamento lentamente hasta formar el habón y lograr contactar con la periferia tumoral.
En los pacientes con carcinomas basocelulares avanzados, el HeberFERON® puede combinarse con ciclos de quimioterapia cada 21 días (máximo 4 ciclos). Las dosis de quimioterapia deben ser calculadas siguiendo el procedimiento Calver. Pueden utilizarse como quimioterapia: cisplatino 50-100 mg/m2, carboplatino 100 mg/m2, adriamicina 50-70 mg/m2.
Administre HeberFERON® tres veces por semana durante 3 semanas por vía perilesional (intradérmica).
Interacciones con otros medicamentos y otras formas de interacción: HeberFERON® puede tener acción sinérgica con algunas drogas antitumorales en cuanto al efecto antiproliferativo, aspecto que se debe tener en cuenta al aplicar la combinación en el tratamiento de algunas neoplasias, ya que también se podría potenciar el efecto mielosupresor de ambos medicamentos.
Embarazo: HeberFERON® no se ha utilizado en mujeres embarazadas. Tampoco hay estudios con el uso de interferón gamma o interferón alfa humano recombinante en mujeres embarazadas. Por tanto, no está establecido su empleo seguro durante el embarazo y el médico debe hacer un análisis de riesgo-beneficio en cada caso antes de usarlo.
Uso en pediatría: HeberFERON® se ha utilizado en niños con hemangiomas sin reacciones adversas severas.
Efectos sobre la conducción de vehículos o maquinarias: La administración de interferón alfa o interferón gamma humano recombinantepuede producir fiebre, decaimiento y malestar general de intensidad variable entre 3 y 4 horas después de la inyección. Estos síntomas pueden afectar la capacidad de conducir vehículos y usar máquinas.
Las pruebas de inocuidad en animales han mostrado tolerancia a megadosis del interferón gamma humano recombinante sin que se produzcan signos de toxicidad. Las pruebas clínicas han corroborado la buena tolerabilidad de este preparado aún a dosis tan elevadas como 20 000 000 UI/m2.
Las reacciones adversas al IFN alfa-2b son dosis-dependientes. A dosis mayores de 10 x 106 UI/m2 de superficie corporal se producen las mismas reacciones adversas aunque con mayor intensidad. Se han descritos estados de astenia intensa y depresión a dosis muy altas. Estos efectos son reversibles.
En el caso de HeberPAG® (combinación de interferón alfa 2b humano recombinante e interferón gamma humano recombinante), las pruebas de seguridad en animales han mostrado tolerancia adecuada dosis altas sin que se produzcan signos de toxicidad sistémica ni efectos adversos. HeberPAG® muestra menor intensidad en sus reacciones adversas que el IFN alfa-2b, a dosis similares o superiores.