Heberon® Alfa R
- Medicamento que contiene interferón alfa 2b humano recombinante.
- Heberon® Alfa R es un importante modificador de la respuesta biológica.
- Es antiviral, antiproliferativo e inmunomodulador.
- Ofrece una excelente respuesta terapéutica ante enfermedades virales, inmunológicas y neoplasias.
- Se han demostrado sus efectos antifibrótico, antiangiogénico y actúa frente a enfermedades del sistema nervioso central.
- Las formas sin albúmina de Heberon®Alfa R no contienen hemoderivados y son menos inmunogénicas.
Polvo liofilizado para inyección intramuscular, intravenosa, subcutánea, intralesional, intraperitoneal e intratecal. Solución para inyección intramuscular, intravenosa, subcutánea, intraperitoneal e intratecal.
3 000 000 UI; 5 000 000 UI; 10 000 000 UI
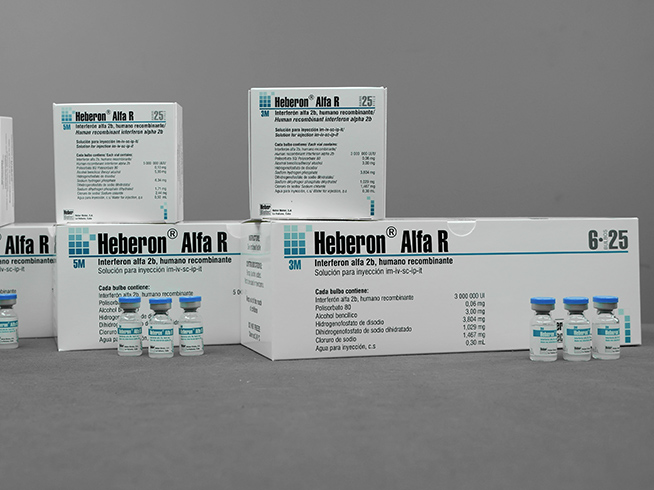
- Heberon® Alfa R 3 M
- Estuche por 1 o 25 bulbos de vidrio incoloro con 0,3 mL
- Estuche con 10 estuches individuales por 1 bulbo de vidrio incoloro con 0,3 mL
- Estuche con 6 estuches por 25 bulbos de vidrio incoloro con 0,3 mL
- Heberon® Alfa R 5 M
- Estuche por 1 o 25 bulbos de vidrio incoloro con 0,5 mL
- Estuche con 10 estuches individuales por 1 bulbo de vidrio incoloro con 0,5 mL
- Estuche con 6 estuches por 25 bulbos de vidrio incoloro con 0,5 mL
- Heberon® Alfa R 10 M
- Estuche por 1 o 25 bulbos de vidrio incoloro con 1 mL
- Estuche con 10 estuches individuales por 1 bulbo de vidrio incoloro con 1 mL
- Estuche con 6 estuches por 25 bulbos de vidrio incoloro con 1 mL
- Heberon® Alfa R 3 M (polvo liofilizado): cada bulbo contiene interferón alfa 2b humano recombinante 3 000 000 UI; hidrogenofosfato de disodio; cloruro de sodio; albúmina sérica humana; dextrana 40; manitol 20 %; dihidrogenofosfato de sodio dihidratado.
- Heberon® Alfa R 5 M (polvo liofilizado): cada bulbo contiene interferón alfa 2b humano recombinante 5 000 000 UI; hidrogenofosfato de disodio; cloruro de sodio; albúmina humana 20 %; dextrana 40; manitol 20 %; dihidrogenofosfato de sodio dihidratado.
- Heberon® Alfa R 10 M (polvo liofilizado): cada bulbo contiene interferón alfa 2b humano recombinante 10 000 000 UI; hidrogenofosfato de disodio; cloruro de sodio; albúmina sérica humana; dextrana 40; manitol 20 %; dihidrogenofosfato de sodio dihidratado.
- Heberon® Alfa R 3 M (solución para inyección): cada bulbo de 0,3 mL contiene interferón alfa 2b humano recombinante 3 000 000 UI; alcohol bencílico 3 mg; cloruro de sodio; polisorbato 80; fosfato de sodio monobásico; fosfato de sodio dibásico; agua para inyección.
- Heberon® Alfa R 5 M (solución para inyección): cada bulbo de 0,5 mL contiene interferón alfa 2b humano recombinante 5 000 000 UI; alcohol bencílico 5 mg; cloruro de sodio; polisorbato 80; fosfato de sodio monobásico; fosfato de sodio dibásico; agua para inyección.
- Heberon® Alfa R 10 M (solución para inyección): cada bulbo de 1 mL contiene interferón alfa 2b humano recombinante 10 000 000 UI; alcohol bencílico 10 mg; cloruro de sodio; polisorbato 80; fosfato de sodio monobásico; fosfato de sodio dibásico; agua para inyección.
Heberon® Alfa R es beneficioso en pacientes que padecen:
- Enfermedades virales: infecciones por papiloma virus humano, hepatitis viral, personas infectadas con el virus de la inmunodeficiencia humana y dengue.
- Neoplasias del tejido hematopoyético: leucemia a células peludas, leucemia mieloide crónica, mieloma múltiple, linfoma no Hodgkin de malignidad baja y media, linfomas T cutáneos (micosis fungoide, síndrome de Sézary y otros).
- Otras enfermedades hematológicas: policitemia vera, trombocitemia e hipereosinofilia.
- Tumores sólidos: carcinoma basocelular de piel, carcinoma superficial de vejiga, melanoma, tumores carcinoides, hemangioma de la infancia, sarcoma de Kaposi asociado al sida, carcinoma renal metastásico.
- Enfermedades por fibrosis: enfermedad de La Peyronié, cirrosis hepática y queloides.
- Enfermedades del sistema nervioso central: esquizofrenia paranoide y esclerosis múltiple.
Heberon® Alfa R está contraindicado en pacientes con hemoglobinopatías o con hipersensibilidad a interferón alfa o a cualquiera de las sales presentes en la preparación.
Ver advertencias especiales y precauciones de uso.
Heberon® Alfa R se debe administrar bajo la supervisión de un médico especialista. El tratamiento puede provocar reacciones adversas de intensidad moderada o grave que obliguen a reducir la dosis, retirar temporalmente el tratamiento o suspenderlo de forma definitiva.
- Sistema cardiovascular: Heberon® Alfa R debe ser administrado con precaución en pacientes con antecedentes de enfermedad cardiaca severa. Aunque no se ha demostrado ningún efecto cardiotóxico directo, es posible que alguno de los efectos secundarios (por ejemplo, fiebre, escalofríos, malestar general), frecuentemente asociados con la administración de Heberon® Alfa R, exacerben una alteración cardiaca anterior.
- Sistema hematológico: El tratamiento con Heberon® Alfa R se ha asociado con una disminución del recuento total de leucocitos, del recuento absoluto de neutrófilos y del recuento de plaquetas, que generalmente comienzan en las dos primeras semanas de tratamiento. Estas disminuciones son reversibles al reducir la dosis o al interrumpir la terapia. Debido a que uno de los efectos tóxicos asociados con el uso de Heberon® Alfa R puede ser leucopenia, se debe ser muy cuidadoso al administrarlo a pacientes con mielosupresión.
- Sistema renal: Heberon® Alfa R debe ser administrado con precaución en pacientes con función renal comprometida o antecedentes de alteraciones renales severas; como el riñón es el sitio donde se metaboliza el interferón alfa, se debe considerar reducción de la dosis del producto, si fuese necesario.
- Psiquiatría y sistema nervioso central (SNC): Se han reportado reacciones adversas del SNC en pacientes tratados con interferón alfa a dosis relativamente altas. Estas reacciones incluyen disminución de la agilidad mental, comportamiento agresivo, confusión y alteraciones del estado mental. La mayoría de estas manifestaciones se presentan con intensidad leve y son reversibles después de reducir la dosis o descontinuar la terapia con interferón alfa. Se han observado también efectos graves en el SNC asociados al uso del interferón alfa, como depresión, ideación suicida e intento de suicidio en algunos pacientes durante el tratamiento e incluso durante los seis meses posteriores a su conclusión.
Heberon® Alfa R debe ser administrado con precaución en pacientes con antecedentes de convulsiones u otra alteración funcional del SNC. En pacientes con antecedentes psiquiátricos, solamente se debe iniciar el tratamiento con Heberon® Alfa R, luego de haber realizado una evaluación diagnóstica especializada para descartar la presencia activa de cualquier episodio, signo o síntoma de trastornos psiquiátricos.
El curso del tratamiento en este tipo de pacientes debe ser cuidadosamente monitoreado, y si se detecta la aparición de cualquiera de estas manifestaciones, se debe considerar la necesidad de aplicar un tratamiento psiquiátrico concomitante; si los síntomas psiquiátricos persisten o empeoran o se aprecia ideación suicida, se recomienda interrumpir de inmediato el tratamiento con Heberon® Alfa R y controlar al paciente con el tratamiento psiquiátrico apropiado.
- Sistema endocrino: Con el empleo de interferones alfa, se han observado aparición de afectaciones en la función tiroidea o empeoramiento de enfermedades tiroideas preexistentes. Los pacientes con hipo o hipertiroidismo no controlado, no deben comenzar el tratamiento con Heberon® Alfa R. Los pacientes que desarrollen algunas alteración tiroidea durante el tratamiento y que no puedan ser controlados con la medicación concomitante o manejos de la dosis de Heberon® Alfa R, deben interrumpir temporalmente el tratamiento con Heberon® Alfa R hasta recuperar la normalidad en la función tiroidea.
- Enfermedades autoinmunes: El uso de diferentes formulaciones de interferón alfa ha sido asociado con el incremento de manifestaciones alérgicas o autoinmunes como broncoconstricción, lupus eritematoso, psoriasis, dermatitis atópica o tiroiditis. A pesar que estas condiciones ocurren con muy baja frecuencia, el Heberon® Alfa R debe ser administrado con precaución en pacientes con antecedentes de enfermedades autoinmunes o alérgicas.
- Oftalmología: Heberon® Alfa R se ha reportado muy poco asociado a cambios oculares en los pacientes. No obstante, el interferón alfa ha sido asociado a retinopatías, incluyendo hemorragias retinianas, manchas algodonosas, edema de papila, neuropatía óptica y obstrucción de las arterias o venas de la retina, que pueden ocasionar una pérdida de la capacidad visual.
- Trastornos pulmonares: Como sucede con otros interferones alfa, se han descrito síntomas pulmonares, incluyendo disnea, infiltrados pulmonares, neumonía y neumonitis durante el tratamiento con Heberon® Alfa R. En presencia de infiltrados pulmonares o de trastornos de la función pulmonar, persistentes o inexplicables, debe ser suspendido el tratamiento.
- Carcinogénesis: No hay evidencia experimental ni en la literatura, que sugiera algún potencial carcinogénico. Por el contrario, se han encontrado efectos del Heberon® Alfa R en el sentido opuesto, sobre la diferenciación en líneas celulares transformadas y en tumores en animales.
- Mutagénesis: Ninguna de las pruebas realizadas ha demostrado o sugerido que Heberon® Alfa R puede ser mutagénico. Estas incluyen la prueba de Ames con cepas diferentes y la prueba con linfocitos humanos en cultivos buscando daño cromosomal.
- Uso en pediatría: Heberon® Alfa R ha sido usado en niños con hepatitis viral tipo B y C, papilomatosis laríngea y respiratoria recurrente, en hemangiomas, así como en neoplasias malignas y benignas. Los efectos secundarios han sido similares a los encontrados en adultos, fundamentalmente fiebre y malestar general. No se han reportado trastornos del crecimiento o del desarrollo psicosomático, aun después de varios meses de tratamiento continuado.
Las reacciones adversas producidas por interferón alfa son dependientes de la dosis y reversibles. A dosis mayores se producen las mismas reacciones adversas que a dosis inferiores, aunque con mayor intensidad. En caso de ocurrir se debe reducir la dosis o discontinuar el tratamiento en dependencia de la situación clínica del paciente. Aunque la experiencia general es que los efectos colaterales disminuyen en la medida en que avanza el esquema terapéutico, su continuación o reinicio debe ser monitoreada cuidadosamente.
Los efectos colaterales principales encontrados con el uso de Heberon® Alfa R son similares a los reportados para otras preparaciones de interferón alfa. Sus intensidades son generalmente leves (no requiere tratamiento) o moderadas (responde al tratamiento sintomático). Los pacientes que reciben dosis ≥ 6 MUI pueden tener reacciones adversas con intensidades severas que requieren medidas adicionales, hospitalización, prolongación de la hospitalización o suspensión del tratamiento.
Frecuencia de las principales reacciones adversas del Heberon® Alfa R en un análisis de 2201 pacientes por el CIGB:
Cefalea (49%), fiebre (41%), astenia (24%), mialgias (23%), anemia (20%), artralgia (18%), escalofríos (16%), leucopenia (15%), anorexia (9%), náuseas (8%); frecuencia de 4%: malestar general, pérdida de peso, vómitos, depresión, trombocitopenia, insomnio, diarrea, dolor en el cuerpo, prurito; frecuencia de 3%: fatiga, mareos, irritación, alopecia, temblores, dolor abdominal, rash e hiperpolimenorrea; frecuencia de 2 %: resequedad bucal; frecuencia de 1 %: somnolencia, calambres y taquicardia; frecuencia de 0,7 %: neutropenia yconfusión mental; frecuencia de 0,6 %: disnea, tos seca; frecuencia de 0,5 %: estomatitis aftosa, dolor en los huesos e hipertensión arterial; frecuencia de 0,4 %: hipotensión, dispepsia, síntomas tipo gripe, odinofagia, irritación ocular, disminución de libido; frecuencia de 0,3 %: rubor facial, infección respiratoria alta, vista borrosa; frecuencia de 0,2 %: sudoraciones, trastorno menstrual, prurito ocular, metrorragia, epitaxis, dolor precordial, irritación de la lengua, sepsis urinaria, edema parpebral, impotencia, hipoglicemia, linfopenia; frecuencia de 0,1 %: dolor en la espalda, ansiedad, hipotiroidismo, hipertransaminasemia, alteraciones del olfato, granulocitosis, anisocitosis, macrocitosis, poiquilocitiosis, macroplaquetas, disfonía, exantema, disgeusia, onicomicosis, orina oscura, asma bronquial, cistitis, dermatitis, meteorismo, ardor en cuero cabelludo, dolor lingual, ardor retroorbital; frecuencia de 0,05 %: espasticidad, lipomas, nódulos subcutáneos, sialorrea, zumbidos en oídos, petequia, desorden estomatológico, adenitis inespecífica, dolor cervical, pirosis, ptosis parpebral, hiperuricemia, linfangitis, monocitosis, disminución de audición, mucositis, neumonía, fotosensibilidad, hematoma en sitio de punción, hipertiroidismo, bradicardia.
Las preparaciones de interferón alfa recombinante son inmunogénicas en una proporción variable de pacientes tratados. Los anticuerpos generados pueden neutralizar la actividad del interferón y, por tanto, impedir o revertir la respuesta al tratamiento. La inmunogenicidad del Heberon® Alfa R ha sido monitoreada empleando muestras de sangre extraídas a pacientes incluidos en los ensayos clínicos realizados con este producto. En 563 pacientes evaluados hubo 14 (2,5 %) con anticuerpos antiinterferón alfa con capacidad neutralizante de la actividad antiviral. El Heberon® Alfa R es menos inmunogénico comparado con las formulaciones similares existentes en el mercado farmacéutico internacional.
En adultos, la dosis estándar es de 3 a 6 MUI. En algunas situaciones particulares de pacientes con cáncer, pueden usarse dosis mayores, teniendo en cuenta que los efectos secundarios serán también más intensos. En niños, la dosis usual es de 3 a 6 MUI por metro cuadrado (m2) de superficie corporal. La frecuencia de administración varía entre diaria, cíclica (tres veces por semana, en días alternos) e intermitente (1-2 veces por semana). Las dos últimas opciones son las más usadas en esquemas de tratamiento prolongados. La vía de administración establecida es la subcutánea; sin embargo, puede emplearse también la intramuscular. Las vías endovenosa, intratecal, intralesional e intraperitoneal son igualmente posibles.
Algunos de los esquemas de tratamiento útiles son:
- Papilomatosis respiratoria recurrente:
Después de la exéresis quirúrgica de las lesiones, se recomienda aplicar el esquema:
| Período | Niños (UI/kg peso corporal) | Adultos (MUI) |
| 1 mes | 100 000 3 v/s | 6 x 106 3 v/s |
| 1 mes | 75 000 3 v/s | 3 x 106 3 v/s |
| 1 mes | 50 000 3 v/s | 3 x 106 3 v/s |
| 1 mes | 50 000 2 v/s | 3 x 106 3 v/s |
| 8 meses | 50 000 1 v/s | 3 x 106 2 v/s |
| 1 año | 50 000 mes | 6 x 106 mes |
Si ocurre alguna recaída, se debe regresar al nivel de dosis o frecuencia inmediata superior.
- Condiloma acuminado
- 6 MUI, tres veces por semana, por vía intramuscular durante seis semanas.
- 3 MUI, tres veces por semana, por vía intramuscular durante seis semanas, combinado con la criocirugía de las lesiones cada 15 días.
- Hepatitis viral subaguda: 12 a 15 MUI durante 3 a 5 días, por vía intraperitoneal o intramuscular, seguido por 6 MUI intramuscular cada dos días. Este tratamiento se continúa hasta que los marcadores virales y de la enfermedad sean negativos.
- Insuficiencia hepática aguda del lactante: 3 a 6 MUI/m2 diarios por vía intraperitoneal durante una semana. La segunda semana, la misma dosis por vía intramuscular. Según la evolución del paciente, se puede reducir la frecuencia de administración a tres veces por semana a partir de la tercera semana. El tratamiento se continúa hasta que los marcadores virales y de la enfermedad sean negativos.
- Hepatitis viral subaguda (subfulminante) en niños mayores de un año: 3 a 6 MUI/m2 durante una a dos semanas: por vía intraperitoneal la primera semana, y por vía intramuscular después. El tratamiento se puede continuar con la misma dosis, tres veces por semana, según los marcadores virales y la situación clínica.
- Hepatitis B crónica:
- En adultos: 6 MUI diarias por vía intramuscular durante dos semanas; después, tres veces por semana durante cuatro semanas, y dos veces por semana durante 16 semanas.
- En niños: 3 a 6 MUI/m2 por vía intramuscular tres veces por semana durante 16 semanas. Si el niño es mayor de 12 años, la dosis debe ser 6 MUI.
- Hepatitis C crónica: 3 MUI por vía intramuscular o subcutánea, tres veces por semana durante 48 semanas. La eficacia del tratamiento aumenta cuando el Heberon® Alfa R se combina con ribavirina en dosis orales diarias de 200 – 400 mg, tres veces al día durante el mismo periodo.
- Personas infectadas con el virus de la inmunodeficiencia humana: 3 MUI, tres veces por semana durante el período asintomático. Este tratamiento debe ser continuado durante un tiempo prolongado con control hematológico, así como monitoreo del posible desarrollo de anticuerpos anti-interferón alfa. En pacientes con sarcoma de Kaposi se recomienda una dosis más alta: 30 MUI/m2/día, como otras preparaciones de interferón alfa recombinante. Sin embargo, en los casos en que el diagnóstico se realizó precozmente, Heberon® Alfa R ha inducido remisiones totales con una dosis de 6 MUI/día durante seis semanas.
- Dengue: Se debe usar antes de 72 horas después del comienzo de los síntomas. En niños, 50 a 100 000 UI/kg de peso, diarias, durante tres días. En adultos, 3 a 6 MUI con la misma frecuencia.
- Leucemia mieloide crónica: Una vez obtenida la remisión hematológica, se puede administrar Heberon® Alfa R en días alternos, a razón de 3 MUI/m2 hasta que se produzca la remisión citogenética, se pueda realizar trasplante de médula ósea u ocurra progresión de la enfermedad.
- Linfomas no Hodgkin de grados bajo y medio de malignidad: Después de haber obtenido la remisión por poliquimioterapia: 6 MUI, tres veces por semana, durante un año o más, hasta la progresión de la enfermedad.
- Carcinoma basocelular de piel: En casos donde la remoción quirúrgica no es posible o no es deseada: 1,5 MUI, por vía intralesional, tres veces por semana, durante tres semanas.
- Carcinoma superficial de vejiga: Instilaciones intravesicales de 20 MUI de Heberon® Alfa R en 50 mL, semanalmente durante ocho semanas y, después, mensualmente durante dos años.
- Hemangioma de la infancia: En tumores mayores de 2 cm de diámetro, 3 MUI/m2, por vía subcutánea, diariamente, durante seis meses y, después, tres veces por semana hasta aproximadamente 12 meses. Esta misma dosis se puede aplicar por vía intralesional, dos veces por semana, si el tumor está bien delimitado.
- Melanoma maligno: Como adyuvante a la cirugía en pacientes sin lesiones residuales pero con riesgo de recurrencias, se debe emplear 20 MUI, cinco veces a la semana por vía endovenosa o intramuscular, durante cuatro semanas. Posteriormente, 10 MUI, tres veces por semana, por vía subcutánea o intramuscular, hasta un año de tratamiento.
- Enfermedad de La Peyronié: Se administra un bulbo de Heberon® Alfa R 10 MUI por vía intralesional, con una frecuencia de dos veces por semana, durante 14 semanas como máximo, o menos en aquellos pacientes que tengan respuesta completa antes.
- Esquizofrenia paranoide: Se administra una dosis de 3 MUI de Heberon® Alfa R dos veces por semana y hasta un año de tratamiento, adyuvante al tratamiento habitual con drogas neurolépticas.
- Esclerosis múltiple: Se administra una dosis de 10 MUI de Heberon® Alfa R dos veces por semana, por vía intramuscular hasta dos años de tratamiento a pacientes con esclerosis múltiple con la forma clínica recaída-remisión que tengan al menos dos recaídas en los últimos dos años. Se aconseja indicar de forma profiláctica antinflamatorios no esteroideos u otros antipiréticos.
Heberon® Alfa R tiene acción sinérgica con algunas drogas antitumorales en cuanto al efecto antiproliferativo, lo que se debe tener en cuenta al aplicar una combinación en el tratamiento de algunas neoplasias, ya que también se potenciaría el efecto mielosupresor de ambos medicamentos. Heberon® Alfa R también tiene acción sinérgica tanto en el efecto antiviral como en el antiproliferativo, con el interferón gamma. No se reportan interacciones con otros medicamentos.
Los estudios no clínicos en modelos animales con ratas no han demostrado ningún efecto teratogénico o sobre la fertilidad debido al Heberon® Alfa R. No existen estudios clínicos para evaluar el efecto del producto en pacientes embarazadas; por tanto, no se puede establecer el uso seguro del Heberon® Alfa R durante el embarazo. La experiencia clínica con este producto en mujeres embarazadas está limitada al tratamiento de 11 casos con trombocitemia o leucemia mieloide crónica, donde no se produjeron alteraciones, excepto un caso de bajo peso al nacer. Por tanto, antes de utilizarlo, el médico debe hacer un análisis riesgo beneficio en cada caso.
La influencia de Heberon® Alfa R sobre la capacidad de conducir y utilizar máquinas es pequeña o moderada. Si el paciente presenta mareos, confusión, somnolencia o fatiga, debe advertírsele que debe evitar conducir vehículos o utilizar máquinas. Sobredosis: Las pruebas de inocuidad en animales han mostrado una tolerancia a dosis enormes del Heberon® Alfa R, sin que se produzcan signos de toxicidad.