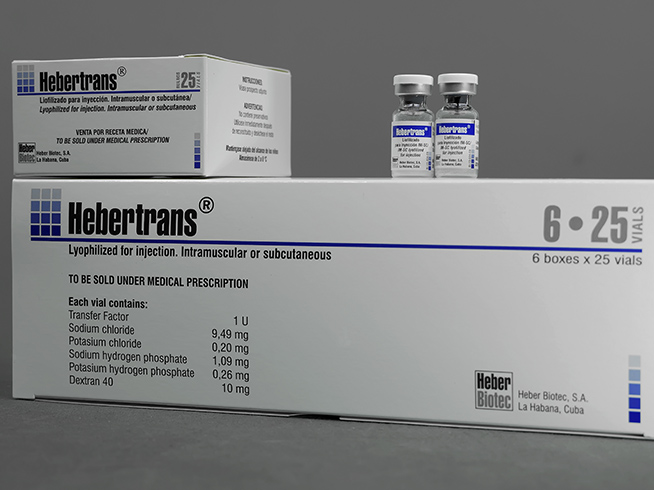
Medicamento que contiene factor de transferencia. Es útil para el tratamiento a pacientes con inmunodeficiencia celular, herpes zóster, herpes simple, cáncer y enfermedades de origen alérgico o autoinmunes.
Liofilizado para inyección intramuscular y subcutánea
Factor de transferencia 1 U
Estuche con 6 estuches por 25 bulbos.
Cada bulbo contiene:
- Factor de transferencia 1 U (equivalente a 1 mg de proteína);
- Cloruro de sodio 9,49 mg;
- Cloruro de potasio 0,20 mg
- Hidrógeno fosfato de disodio 1.09 mg
- Dihidrogenofosfato de potasio 0.26 mg
- 10 mg de dextrana 40
Almacenar de 2 a 8 °C.
Hebertrans® inyectable es útil para pacientes con:
En niños con infección herpética mucocutánea recidivante e inmunodeficiencia celular, el uso de Hebertrans® ha resultado beneficioso en tanto ha reducido el tiempo de curación de las lesiones, de la frecuencia de recidivas y de la normalización o mejoría de los parámetros indicadores de inmunidad celular. También se ha reportado buena evolución en meningoencefalitis herpética severa.
En queratitis herpética, el uso de Hebertrans® en días alternos, combinado con terapia antiviral, en un estudio a doble ciega, produjo disminución de la frecuencia de aparición de complicaciones (p = 0,08) (uveítis, distrofia corneal) y reducción del tiempo de curación de las lesiones (p = 0,002).
En niños con dermatitis atópica, el tratamiento con Hebertrans® causó mejoría clínica y de laboratorio significativas (11/12) en los pacientes en los que la enfermedad concurría con inmunodeficiencia celular; pero no se evidenció el efecto en 10 pacientes con inmunidad celular normal.
Se han reportado buenos resultados tras el uso de Hebertrans® en pacientes con queratoconjuntivitis alérgica.
Hebertrans® está contraindicado en pacientes con hipersensibilidad a la dextrana o a cualquiera de las sales presentes en la preparación.
No hay estudios acerca del uso de Hebertrans® en mujeres embarazadas. Por tanto, el médico debe hacer un análisis de riesgo-beneficio en cada caso antes de usarlo.
No contiene preservantes. Utilícese inmediatamente después de reconstituido.
No debe usarse si, una vez reconstituido, presenta precipitado, turbidez o color.
Excepto ligero eritema en el sitio de inyección en el 2 % de los casos, no se ha reportado efecto secundario de importancia con el uso de Hebertrans®.
En niños que han recibido Hebertrans® durante más de 2 meses no se han encontrado efectos adversos sobre el crecimiento o desarrollo psicosomático.
En adultos, la dosis que más se emplea es de 1 U. En niños, la dosis es 1 o 2 U/m2 de superficie corporal.
La frecuencia de administración puede variar en dependencia del diagnóstico y la evolución de la enfermedad: entre 1 U diaria hasta 7 días, y de 1 a 2 U/semana.
En algunos pacientes con enfermedades crónicas, el tratamiento se puede prolongar hasta 6 meses.
No se han reportado hasta la fecha.
No hay estudios acerca del uso de Hebertrans® en mujeres embarazadas. Por tanto, no está establecido su empleo seguro durante el embarazo y el médico debe hacer un análisis de riesgo-beneficio en cada caso antes de usarlo.
Hebertrans® ha sido utilizado en niños con inmunodeficiencias primarias e infecciones a repetición, sobre todo del tracto respiratorio superior, infecciones por virus herpes y otros. No se han reportado efectos secundarios importantes ni trastornos del crecimiento o del desarrollo psicosomático, aun después de varios meses de tratamiento continuado.
No se han reportado hasta la fecha.
No está descrita la sobredosis de este producto. Los estudios de toxicidad en animales indican que es muy poco tóxico aun en dosis de 3 U/kg, muy superiores a las dosis terapéuticas en seres humanos.